Генетические особенности цитохрома P450. Метаболизм лекарств. Микросомальное окисление повышает реакционную способность молекул Ингибиторы цитохрома 450
 Цитохромы Р 450 (КФ 1. 14. 1) – семейство гемсодержащих монооксигеназ, осуществляющих метаболизм ксенобиотиков, в том числе лекарственных препаратов. Локализованы в гладком эндоплазматическом ретикулуме клетки, открыты – Д. Гарфинкель, М. Клингенберг, 1958.
Цитохромы Р 450 (КФ 1. 14. 1) – семейство гемсодержащих монооксигеназ, осуществляющих метаболизм ксенобиотиков, в том числе лекарственных препаратов. Локализованы в гладком эндоплазматическом ретикулуме клетки, открыты – Д. Гарфинкель, М. Клингенберг, 1958.
 Цитохром Р 450 (англ. Cytochrome P 450, CYP) Название указывает на то, что он окрашен (Р – от английского Pigment). Цитохром Р 450, связанный с монооксидом углерода, имеет максимум поглощения света при длине волны 450 нм, что определило его название (Т. Омура и Р. Сато в 1964 г.). СО не имеет никакого отношения к функции Р 450. Он добавляется для того, чтобы облегчить определение содержания Р 450 по интенсивности спектра поглощения.
Цитохром Р 450 (англ. Cytochrome P 450, CYP) Название указывает на то, что он окрашен (Р – от английского Pigment). Цитохром Р 450, связанный с монооксидом углерода, имеет максимум поглощения света при длине волны 450 нм, что определило его название (Т. Омура и Р. Сато в 1964 г.). СО не имеет никакого отношения к функции Р 450. Он добавляется для того, чтобы облегчить определение содержания Р 450 по интенсивности спектра поглощения.
 Использование термина «цитохром» применительно к гемопротеинам класса Р 450 нельзя считать удачным, так как функцией цитохромов является перенос электронов, а не катализ монооксигеназных реакций. Цитохром Р-450 относится к цитохромам типа b. Предшественник гема – протопорфирин IX.
Использование термина «цитохром» применительно к гемопротеинам класса Р 450 нельзя считать удачным, так как функцией цитохромов является перенос электронов, а не катализ монооксигеназных реакций. Цитохром Р-450 относится к цитохромам типа b. Предшественник гема – протопорфирин IX.
 Молекулярная масса различных цит. Р 450 колеблется 44 - 60 к. Да. Мономеры гемопротеина состоят из одной полипептидной цепи, содержащей от 45 до 55% неполярных аминокислотных остатков. Полная аминокислотная последовательность установлена для более чем 150 цит. Р 450. С помощью рентгеновской кристаллографии детально изучена трехмерная структура цит. Р 450 из P. putida. Белок содержит 414 аминокислотных остатков, М. м. - 47 к. Да, представляет собой асимметричную призму с основанием 3, 0 нм и сторонами по 5, 5 и 6, 0 нм.
Молекулярная масса различных цит. Р 450 колеблется 44 - 60 к. Да. Мономеры гемопротеина состоят из одной полипептидной цепи, содержащей от 45 до 55% неполярных аминокислотных остатков. Полная аминокислотная последовательность установлена для более чем 150 цит. Р 450. С помощью рентгеновской кристаллографии детально изучена трехмерная структура цит. Р 450 из P. putida. Белок содержит 414 аминокислотных остатков, М. м. - 47 к. Да, представляет собой асимметричную призму с основанием 3, 0 нм и сторонами по 5, 5 и 6, 0 нм.
 Цит. Р 450 из P. putida содержит 4 антипараллельных спиральных участка, смесь спиралей и неупорядоченных структур, перемежающихся параллельными бета-структурами. Гем расположен между двумя параллельными спиралями. С пропионовыми группами гема взаимодействуют остатки Arg-112, Arg-229 и His-335. Другие аминокислоты, окружающие гем, неполярны. Гем не выходит на поверхность молекулы. Наименьшее расстояние от поверхности до гема составляет около 0, 8 нм.
Цит. Р 450 из P. putida содержит 4 антипараллельных спиральных участка, смесь спиралей и неупорядоченных структур, перемежающихся параллельными бета-структурами. Гем расположен между двумя параллельными спиралями. С пропионовыми группами гема взаимодействуют остатки Arg-112, Arg-229 и His-335. Другие аминокислоты, окружающие гем, неполярны. Гем не выходит на поверхность молекулы. Наименьшее расстояние от поверхности до гема составляет около 0, 8 нм.
 Все мембранные цитохромы Р 450 на N-концевом фрагменте пептидной цепи имеют короткий гидрофобный участок, содержащий от 12 до 21 аминокислотных остатков. Он выполняет роль якорного пептида и содержит сигнальную последовательность, ответственную за встраивание белка в мембрану. За ним расположена стопсигнальная последовательность, останавливающая встраивание пептида в фосфолипидный бислой.
Все мембранные цитохромы Р 450 на N-концевом фрагменте пептидной цепи имеют короткий гидрофобный участок, содержащий от 12 до 21 аминокислотных остатков. Он выполняет роль якорного пептида и содержит сигнальную последовательность, ответственную за встраивание белка в мембрану. За ним расположена стопсигнальная последовательность, останавливающая встраивание пептида в фосфолипидный бислой.
 Цитохромы P 450 отсутствуют только у облигатно анаэробных организмов. Описано не менее 11 500 ? белков системы Цит. P 450 бактерий и архей растворены в цитоплазме. Переход к эукариотическим системам сопровождался встраиванием P 450 в мембрану. Все цит. P 450 высших организмов - мембранные ферменты. В эволюционном плане наиболее древней является бактериальная монооксигеназа.
Цитохромы P 450 отсутствуют только у облигатно анаэробных организмов. Описано не менее 11 500 ? белков системы Цит. P 450 бактерий и архей растворены в цитоплазме. Переход к эукариотическим системам сопровождался встраиванием P 450 в мембрану. Все цит. P 450 высших организмов - мембранные ферменты. В эволюционном плане наиболее древней является бактериальная монооксигеназа.
 Система цит. P 450 участвует в окислении многочисленных соединений, как эндогенных, так и экзогенных. Цит. Р 450 -зависимые монооксигеназы катализируют расщепление различных веществ с участием донора электронов и молекулярного кислорода. В этой реакции один атом кислорода присоединяется к субстрату, а второй восстанавливается до воды. Центр связывания кислорода – высокоспецифичен, центр связывания преобразуемого субстрата – относительно.
Система цит. P 450 участвует в окислении многочисленных соединений, как эндогенных, так и экзогенных. Цит. Р 450 -зависимые монооксигеназы катализируют расщепление различных веществ с участием донора электронов и молекулярного кислорода. В этой реакции один атом кислорода присоединяется к субстрату, а второй восстанавливается до воды. Центр связывания кислорода – высокоспецифичен, центр связывания преобразуемого субстрата – относительно.
 Ферменты семейства цитохрома P 450 разнообразны и различаются: по функциям, типами ферментативной активности, регуляторами активности (ингибитораи, индукторами). Отдельные изоформы (изоферменты) цит. Р-450 отличаются определенной специфичностью и каждая из них участвует в метаболизме относительно небольшого количества веществ.
Ферменты семейства цитохрома P 450 разнообразны и различаются: по функциям, типами ферментативной активности, регуляторами активности (ингибитораи, индукторами). Отдельные изоформы (изоферменты) цит. Р-450 отличаются определенной специфичностью и каждая из них участвует в метаболизме относительно небольшого количества веществ.
 Цитохром Р 450, наряду с монооксигеназной активностью, может проявлять оксидазную (А. И. Арчаков с сотр.), т. е. катализировать удаление водорода из субстрата, используя при этом в качестве акцептора водорода кислород и восстанавливать его до воды, или генерировать активные формы кислорода в виде супероксидного и гидроксильного радикалов, пероксида водорода. Р 450 обнаруживает пероксидазную активность, используя в реакциях окисления в качестве косубстратов вместо NADPH органические пероксиды или пероксид водорода. Имеются данные, что Р 450 может катализировать диоксигеназные реакции, вводить в окисляемое вещество два атома кислорода. Таким образом, характерной особенностью Р 450 является множественность функций, но основной является монооксигеназная.
Цитохром Р 450, наряду с монооксигеназной активностью, может проявлять оксидазную (А. И. Арчаков с сотр.), т. е. катализировать удаление водорода из субстрата, используя при этом в качестве акцептора водорода кислород и восстанавливать его до воды, или генерировать активные формы кислорода в виде супероксидного и гидроксильного радикалов, пероксида водорода. Р 450 обнаруживает пероксидазную активность, используя в реакциях окисления в качестве косубстратов вместо NADPH органические пероксиды или пероксид водорода. Имеются данные, что Р 450 может катализировать диоксигеназные реакции, вводить в окисляемое вещество два атома кислорода. Таким образом, характерной особенностью Р 450 является множественность функций, но основной является монооксигеназная.
 Цит. P-450 кодируются суперсемейством генов. У человека в системе цит. Р-450 выявлено 57 генов и более 59 псевдогенов (нефункциональные аналоги структурных генов, утратившие способность кодировать белок и не экспрессирующиеся в клетке. Термин «псевдоген» был впервые предложен в 1977 году.). Nebert (1987) была разработана классификация цит. Р-450, основанная на дивергентной эволюции и гомологии последовательностей нуклеoтид/ аминокислотной. Суперсемейство подразделяется на 18 семейств и 43 подсемейства. Номенклатура генов цит. Р-450 человека описана подробно.
Цит. P-450 кодируются суперсемейством генов. У человека в системе цит. Р-450 выявлено 57 генов и более 59 псевдогенов (нефункциональные аналоги структурных генов, утратившие способность кодировать белок и не экспрессирующиеся в клетке. Термин «псевдоген» был впервые предложен в 1977 году.). Nebert (1987) была разработана классификация цит. Р-450, основанная на дивергентной эволюции и гомологии последовательностей нуклеoтид/ аминокислотной. Суперсемейство подразделяется на 18 семейств и 43 подсемейства. Номенклатура генов цит. Р-450 человека описана подробно.
 В настоящее время известны тысячи изоформ (изоферментов) цит. Р-450. Изоформы, имеющие более 40 % общего аминокислотного состава, объединены в семейства и обозначаются арабскими цифрами (CYP 1, CYP 2, CYP 3 и т. д.). Подсемейства обозначаются латинскими буквами и объединяют изоформы с идентичностью аминокислотного состава более 55 % (CYP 2 D, CYP 3 A и т. д.) В подсемействе отдельные изоформы обозначаются арабскими цифрами, следующими за латинскими буквами (CYP 1 A 2, CYP 2 D 6, CYP 3 A 4). Ксенобиотик может быть субстратом двух и более изоформы. Разные изоформы способны метаболизировать одно вещество в различных участках его молекулы
В настоящее время известны тысячи изоформ (изоферментов) цит. Р-450. Изоформы, имеющие более 40 % общего аминокислотного состава, объединены в семейства и обозначаются арабскими цифрами (CYP 1, CYP 2, CYP 3 и т. д.). Подсемейства обозначаются латинскими буквами и объединяют изоформы с идентичностью аминокислотного состава более 55 % (CYP 2 D, CYP 3 A и т. д.) В подсемействе отдельные изоформы обозначаются арабскими цифрами, следующими за латинскими буквами (CYP 1 A 2, CYP 2 D 6, CYP 3 A 4). Ксенобиотик может быть субстратом двух и более изоформы. Разные изоформы способны метаболизировать одно вещество в различных участках его молекулы
 Цит. P 450 катализируют ω-окисление насыщенных жирных кислот (ж. к.), перекисное окисление ненасыщеных ж. к. , гидроксилирование стероидных гормонов, желчных кислот и холестерола, биосинтез простагландинов (локализованы в митохондриях, на ядерной мембране). Цитохромы P 450 микросом участвуют в метаболической биотрансформации ксенобиотиков (лекарств, ядов, наркотических веществ). В метаболизме ЛС принимают участие изоформы семейств I, II и III, из них основные - IA 1, 1 А 2, 2 А 6, 2 В 6, 2 D 6, 2 С 9, 2 С 19, 2 Е 1, ЗА 4.
Цит. P 450 катализируют ω-окисление насыщенных жирных кислот (ж. к.), перекисное окисление ненасыщеных ж. к. , гидроксилирование стероидных гормонов, желчных кислот и холестерола, биосинтез простагландинов (локализованы в митохондриях, на ядерной мембране). Цитохромы P 450 микросом участвуют в метаболической биотрансформации ксенобиотиков (лекарств, ядов, наркотических веществ). В метаболизме ЛС принимают участие изоформы семейств I, II и III, из них основные - IA 1, 1 А 2, 2 А 6, 2 В 6, 2 D 6, 2 С 9, 2 С 19, 2 Е 1, ЗА 4.
 Общие индукторы Ферменты Индуктор Фенобарбита Тяжелые металлы л Система цитохрома P 450 Индуктор Противоопухолевые лекарства Метилхолантрен Система цитохрома P 448 Эпоксидгидролазы Глутатион и УДФглюкуронилтрансферазы Синтез GSH Металлотионеины Р-гликопротеин Индуктор
Общие индукторы Ферменты Индуктор Фенобарбита Тяжелые металлы л Система цитохрома P 450 Индуктор Противоопухолевые лекарства Метилхолантрен Система цитохрома P 448 Эпоксидгидролазы Глутатион и УДФглюкуронилтрансферазы Синтез GSH Металлотионеины Р-гликопротеин Индуктор
 Фенобарбитал активирует синтез цит. Р 450, УДФглюкуронилтрансферазы и эпоксид гидролазы. Например, у животных, которым вводили индуктор фенобарбитал, увеличивается площадь мембран ЭР, которая достигает 90 % всех мембранных структур клетки, и, как следствие, - увеличение количества ферментов, участвующих в обезвреживании ксенобиотиков или токсических веществ эндогенного происхождения. Одновременный прием фенобарбитала и некоторых лекарственных препаратов, метаболизирующих при участии цит. Р 450, приводит к снижению эффективности последних за счет трансформации молекулы в процессе биотрансформации или быстрого их удаления из организма.
Фенобарбитал активирует синтез цит. Р 450, УДФглюкуронилтрансферазы и эпоксид гидролазы. Например, у животных, которым вводили индуктор фенобарбитал, увеличивается площадь мембран ЭР, которая достигает 90 % всех мембранных структур клетки, и, как следствие, - увеличение количества ферментов, участвующих в обезвреживании ксенобиотиков или токсических веществ эндогенного происхождения. Одновременный прием фенобарбитала и некоторых лекарственных препаратов, метаболизирующих при участии цит. Р 450, приводит к снижению эффективности последних за счет трансформации молекулы в процессе биотрансформации или быстрого их удаления из организма.
 В настоящее время описано более 250 химических соединений, вызывающих индукцию микросомальных ферментов. Индукторы монооксигеназных систем разделяются на два класса. Представители первого класса (инсектициды, этанол и др.) вызывают выраженную пролиферацию гладкого эндоплазматического ретикулума в гепатоцитах и увеличение активности цитохрома Р 450. Стимуляция метаболизма, вызываемая индукторами второго класса (ПАУ - полициклические ароматические углеводороды: тетрахлордибензодиоксин, 3 -метилхолантрен, бенз(а)пирен и др. , не сопровождается пролиферацией гладкого эндоплазматического ретикулума, но при этом существенно возрастает активность многих ферментов биотрансформации. Усиление метаболизма большинства ксенобиотиков приводит к снижению токсичности. Вместе с тем токсичность некоторых ксенобиотиков под воздействием индукторов существенно возрастает. Например, усиливается токсичность четыреххлористого углерода, бромбензола, иприта и т. д.
В настоящее время описано более 250 химических соединений, вызывающих индукцию микросомальных ферментов. Индукторы монооксигеназных систем разделяются на два класса. Представители первого класса (инсектициды, этанол и др.) вызывают выраженную пролиферацию гладкого эндоплазматического ретикулума в гепатоцитах и увеличение активности цитохрома Р 450. Стимуляция метаболизма, вызываемая индукторами второго класса (ПАУ - полициклические ароматические углеводороды: тетрахлордибензодиоксин, 3 -метилхолантрен, бенз(а)пирен и др. , не сопровождается пролиферацией гладкого эндоплазматического ретикулума, но при этом существенно возрастает активность многих ферментов биотрансформации. Усиление метаболизма большинства ксенобиотиков приводит к снижению токсичности. Вместе с тем токсичность некоторых ксенобиотиков под воздействием индукторов существенно возрастает. Например, усиливается токсичность четыреххлористого углерода, бромбензола, иприта и т. д.
 Имеются химические вещества, способные ингибировать как ферменты 1 -й фазы биотрансформации (изоферменты цитохрома Р-450) и 2 -й фазы биотрансформации (N- ацетилтрансфераза и др.), так и транспортеры 3 -й фазы (РАТФазы). При снижении активности ферментов метаболизма возможно развитие побочных эффектов, связанных с длительной циркуляцией этих соединений в организме. Ингибирование транспортеров, как и их индукция, может приводить к различным изменениям (преимущественно к повышению) концентрации ксенобиотиков в плазме крови в зависимости от функций данного транспортера.
Имеются химические вещества, способные ингибировать как ферменты 1 -й фазы биотрансформации (изоферменты цитохрома Р-450) и 2 -й фазы биотрансформации (N- ацетилтрансфераза и др.), так и транспортеры 3 -й фазы (РАТФазы). При снижении активности ферментов метаболизма возможно развитие побочных эффектов, связанных с длительной циркуляцией этих соединений в организме. Ингибирование транспортеров, как и их индукция, может приводить к различным изменениям (преимущественно к повышению) концентрации ксенобиотиков в плазме крови в зависимости от функций данного транспортера.
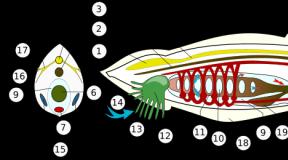
 Элетронтранспортные цепи ЭПР 1 цепь включает: 1) цитохром P 450, имеет центры связывания для O 2 и гидрофобного субстрата; 2) NADPH-цитохром P 450 редуктазу, содержащую коферменты FAD и FMN; 3) NADPH+H+ – донор ē и Н+ в этой электрон-транспортной цепи; 4) O 2. 2 цепь включает: 1) цитохром P 450; 2) фермент NADH-цитохром b 5 редуктазу, коферментом которой является FAD; 3) цитохром b 5 – гемопротеин, переносящий ē от NADH-цитохром b 5 редуктазы на цитохром P 450; 4) NADH + Н+ – донор ē и Н+; 5) O 2. Цитохром P 450 один атом O 2 включает в молекулу субстрата, а 2 -й восстанавливает с образованием H 2 O за счет переноса ē и Н+ от NADPH+H+ при участии цитохром P 450 -редуктазы (или от NADH+H+ с помощью цитохром b 5 редуктазы и цитохрома b 5).
Элетронтранспортные цепи ЭПР 1 цепь включает: 1) цитохром P 450, имеет центры связывания для O 2 и гидрофобного субстрата; 2) NADPH-цитохром P 450 редуктазу, содержащую коферменты FAD и FMN; 3) NADPH+H+ – донор ē и Н+ в этой электрон-транспортной цепи; 4) O 2. 2 цепь включает: 1) цитохром P 450; 2) фермент NADH-цитохром b 5 редуктазу, коферментом которой является FAD; 3) цитохром b 5 – гемопротеин, переносящий ē от NADH-цитохром b 5 редуктазы на цитохром P 450; 4) NADH + Н+ – донор ē и Н+; 5) O 2. Цитохром P 450 один атом O 2 включает в молекулу субстрата, а 2 -й восстанавливает с образованием H 2 O за счет переноса ē и Н+ от NADPH+H+ при участии цитохром P 450 -редуктазы (или от NADH+H+ с помощью цитохром b 5 редуктазы и цитохрома b 5).

 Еще одна схема организации электронтранспортной цепи ЭПР Источником электронов и протонов в цепи является НАДФН+Н+, который образуется в реакциях пентозофосфатного пути окисления глюкозы. Промежуточным акцептором Н+ и е- служит флавопротеин, содержащий кофермент ФАД (цитохром Р 450 -редуктаза). Конечное звено в цепи микросомального окисления - цитохром Р 450, восстанавливающий кислород до воды. Работа системы цит. Р-450 сопряжена с работой системы цит. b-5, источником электронов и протонов в которой является НАДН+Н+, образующийся в гликолизе. Промежуточным акцептором Н+ и е- служит флавопротеин, содержащий кофермент ФАД (цитохром b-5 -редуктаза).
Еще одна схема организации электронтранспортной цепи ЭПР Источником электронов и протонов в цепи является НАДФН+Н+, который образуется в реакциях пентозофосфатного пути окисления глюкозы. Промежуточным акцептором Н+ и е- служит флавопротеин, содержащий кофермент ФАД (цитохром Р 450 -редуктаза). Конечное звено в цепи микросомального окисления - цитохром Р 450, восстанавливающий кислород до воды. Работа системы цит. Р-450 сопряжена с работой системы цит. b-5, источником электронов и протонов в которой является НАДН+Н+, образующийся в гликолизе. Промежуточным акцептором Н+ и е- служит флавопротеин, содержащий кофермент ФАД (цитохром b-5 -редуктаза).
 Пример RH – субстрат цит. Р-450; стрелками показаны реакции переноса электронов. Восстановленную форму цит. -b 5 окисляет стеароил-Ко. А-монооксигеназа, которая переносит электроны на О₂. Один атом О₂ принимает 2 е¯ и переходит в форму О²¯. Донором электронов служит НАДФН, который окисляется НАДФН-цит. Р-450 редуктазой. О²¯ взаимодействует с протонами с образованием воы: О²¯ + 2 Н⁺ → Н₂О Второй актом кислорода включается в субстрат RH, образую гидроксильную группу вещества R-OH.
Пример RH – субстрат цит. Р-450; стрелками показаны реакции переноса электронов. Восстановленную форму цит. -b 5 окисляет стеароил-Ко. А-монооксигеназа, которая переносит электроны на О₂. Один атом О₂ принимает 2 е¯ и переходит в форму О²¯. Донором электронов служит НАДФН, который окисляется НАДФН-цит. Р-450 редуктазой. О²¯ взаимодействует с протонами с образованием воы: О²¯ + 2 Н⁺ → Н₂О Второй актом кислорода включается в субстрат RH, образую гидроксильную группу вещества R-OH.
 НАДФ-Н-цитохром Р-450 -редуктаза – флавопротеин. Один моль фермента содержит по одному молю флавинмононуклеотида (ФМН) и флавинадениндинуклеотида (ФАД). Поскольку цитохром С может служить акцептором электрона (используется в модельных системах), указанный фермент часто называют НАДФ-цитохром Средуктазой.
НАДФ-Н-цитохром Р-450 -редуктаза – флавопротеин. Один моль фермента содержит по одному молю флавинмононуклеотида (ФМН) и флавинадениндинуклеотида (ФАД). Поскольку цитохром С может служить акцептором электрона (используется в модельных системах), указанный фермент часто называют НАДФ-цитохром Средуктазой.
 Механизм гидроксилирования субстрата при участии цитохрома Р-450 Условно можно выделить 5 этапов: 1. окисляемое вещество (S) образует комплекс с окисленной формой цитохрома Р-450; 2. происходит восстановление этого комплекса электроном от НАДФН; 3. восстановленный комплекс соединяется с молекулой O 2; 4. O 2 в составе комплекса присоединяет ещё один электрон с НАДФН; 5. комплекс распадается с образованием молекулы Н 2 О, окисленной формы цитохрома Р-450 и гидроксилированного субстрата (S-ОН).
Механизм гидроксилирования субстрата при участии цитохрома Р-450 Условно можно выделить 5 этапов: 1. окисляемое вещество (S) образует комплекс с окисленной формой цитохрома Р-450; 2. происходит восстановление этого комплекса электроном от НАДФН; 3. восстановленный комплекс соединяется с молекулой O 2; 4. O 2 в составе комплекса присоединяет ещё один электрон с НАДФН; 5. комплекс распадается с образованием молекулы Н 2 О, окисленной формы цитохрома Р-450 и гидроксилированного субстрата (S-ОН).

 В отличие от митохондриальной дыхательной цепи, в монооксигеназной цепи при переносе электронов не происходит аккумулирования энергии в виде АТФ. Микросомальное окисление является свободным окислением. В большинстве случаев гидроксилирование чужеродных веществ снижает их токсичность. Однако могут образоваться продукты с цитотоксическими, мутагенными и канцерогенными свойствами.
В отличие от митохондриальной дыхательной цепи, в монооксигеназной цепи при переносе электронов не происходит аккумулирования энергии в виде АТФ. Микросомальное окисление является свободным окислением. В большинстве случаев гидроксилирование чужеродных веществ снижает их токсичность. Однако могут образоваться продукты с цитотоксическими, мутагенными и канцерогенными свойствами.

 Цитохромы Р-450 являются мембранными белками и при исследовании их каталитической активности требуется сложное реконструирование монооксигеназной системы с использованием редокс-партнеров и фосфолипидов. Кроме того, изоферменты цит. Р-450 быстро инактивируются. Электрохимический метода анализа существенно упростил определение активности цит. Р-450. Первые работы, посвященные использованию электрода в качестве донора электронов для катализа цит. Р-450 (CYP 3 А 4): Кузнецов Б. А. , Местечкина Н. М. , Изотов М. В. , Карузина И. И. , Карякин А. В. , Арчаков А. И. (1979) Биохимия, 44, 1569 -1574. Арчаков А. И. , Кузнецов Б. А. , Изотов М. В. , Карузина И. И. (1981) Биофизика, 26, 352 -354.
Цитохромы Р-450 являются мембранными белками и при исследовании их каталитической активности требуется сложное реконструирование монооксигеназной системы с использованием редокс-партнеров и фосфолипидов. Кроме того, изоферменты цит. Р-450 быстро инактивируются. Электрохимический метода анализа существенно упростил определение активности цит. Р-450. Первые работы, посвященные использованию электрода в качестве донора электронов для катализа цит. Р-450 (CYP 3 А 4): Кузнецов Б. А. , Местечкина Н. М. , Изотов М. В. , Карузина И. И. , Карякин А. В. , Арчаков А. И. (1979) Биохимия, 44, 1569 -1574. Арчаков А. И. , Кузнецов Б. А. , Изотов М. В. , Карузина И. И. (1981) Биофизика, 26, 352 -354.
 В настоящее время разработаны электрохимические биосенсорные системы на основе иммобилизованных на электроде цитохромов Р-450. Электрокаталитическая реакция инициируется электронами с электрода. Это исключает необходимость использования редокс-партнеров монооксигеназной системы и восстановительных эквивалентов НАДФН. Определение каталитической активности иммобилизованного цит. Р-450 осуществляется с помощью регистрации каталитического тока, возникающего при внесении в электрохимическую систему субстрата. Регистрарация каталитического тока осуществляется методами вольтамперометрии или амперометрии и позволяет рассчитать многие характеристики ферментативного процесса: константу Михаэлиса-Ментен, электрохимическую каталитическую константу.
В настоящее время разработаны электрохимические биосенсорные системы на основе иммобилизованных на электроде цитохромов Р-450. Электрокаталитическая реакция инициируется электронами с электрода. Это исключает необходимость использования редокс-партнеров монооксигеназной системы и восстановительных эквивалентов НАДФН. Определение каталитической активности иммобилизованного цит. Р-450 осуществляется с помощью регистрации каталитического тока, возникающего при внесении в электрохимическую систему субстрата. Регистрарация каталитического тока осуществляется методами вольтамперометрии или амперометрии и позволяет рассчитать многие характеристики ферментативного процесса: константу Михаэлиса-Ментен, электрохимическую каталитическую константу.
 Зависимость изменения каталитического тока при амперметрическом титровании цит. Р-450 3 А 4 (CYP 3 А 4) тестостероном при контролируемом напряжении Е = -0, 5 В (vs. Ag/Ag. Cl). На вставке – рассчет элктрохимической Км [тестостерон]. (В. В. Шумянцева и соав. , 2015)
Зависимость изменения каталитического тока при амперметрическом титровании цит. Р-450 3 А 4 (CYP 3 А 4) тестостероном при контролируемом напряжении Е = -0, 5 В (vs. Ag/Ag. Cl). На вставке – рассчет элктрохимической Км [тестостерон]. (В. В. Шумянцева и соав. , 2015)
 Разработка биосенсоров на основе электрохимических цитохром Р 450 -содержащих систем позволяет выявлять субстраты (ксенобиотики), исследовать эффекты лекарственных препаратов на каталитическую активность конкретных изоформ цитохрома Р 450. Цель – создание сенсорных устройств, пригодных для использования в персонифицированной медицине, проведения экспериментов по изучению влияния лекарственных препаратов на активность СYР в системах электрод/цитохром Р 450.
Разработка биосенсоров на основе электрохимических цитохром Р 450 -содержащих систем позволяет выявлять субстраты (ксенобиотики), исследовать эффекты лекарственных препаратов на каталитическую активность конкретных изоформ цитохрома Р 450. Цель – создание сенсорных устройств, пригодных для использования в персонифицированной медицине, проведения экспериментов по изучению влияния лекарственных препаратов на активность СYР в системах электрод/цитохром Р 450.
 Преимущества электрохимического метода исследования цитохром Р 450 -монооксигеназной системы 1) электрохимическая система не требует использования дорогостоящих и неустойчивых восстановительных эквивалентов NADPH и NADH, т. к. применяется альтернативный источник электронов – электрод; 2) не требует полного реконструирования монооксигеназной системы (использования всех компонентов микросомальной системы и белков редокс-партнеров каталитического цикла цитохрома Р 450); 3) метод обладает высокой чувствительностью и позволяет использовать минимальное количество дорогостоящего фермента (до 10 -12 мкмоль белка/электрод); 4) электрокатализ и контролируемость ферментативного процесса с помощью электрического тока обладает высокой эффективностью; 5) можно предотвращать инактивацию интактных изоформ Р 450 путем использования различных синтетических модификаторов поверхности электрода.
Преимущества электрохимического метода исследования цитохром Р 450 -монооксигеназной системы 1) электрохимическая система не требует использования дорогостоящих и неустойчивых восстановительных эквивалентов NADPH и NADH, т. к. применяется альтернативный источник электронов – электрод; 2) не требует полного реконструирования монооксигеназной системы (использования всех компонентов микросомальной системы и белков редокс-партнеров каталитического цикла цитохрома Р 450); 3) метод обладает высокой чувствительностью и позволяет использовать минимальное количество дорогостоящего фермента (до 10 -12 мкмоль белка/электрод); 4) электрокатализ и контролируемость ферментативного процесса с помощью электрического тока обладает высокой эффективностью; 5) можно предотвращать инактивацию интактных изоформ Р 450 путем использования различных синтетических модификаторов поверхности электрода.
 Методы оценки состояния системы биотранс- формации ксенобиотиков: 1) Высокоэффективная жидкостная хроматография (ВЭЖХ). Дает возможность исследовать аналиты в моче, крови, слюне, другом биологическом материале после введения ксенобиотика (лекарственного вещества). Можно проводить кинетический анализ, позволяющий определить период полувыведения тестового препарата, объем кажущегося распределения, клиренс элиминации, исследовать другие параметры. Аналит – это компонент или характеристика образца, подлежащий (ая) измерению. Это понятие включает в себя любой элемент: ион, соединение, вещество, фактор, инфекционный агент, клетку, органеллу, активность (ферментативную, гормональную, иммунологическую) или признак: наличие или отсутствие, концентрацию, активность, интенсивность или другие характеристики, которые необходимо определить. Понятие сформулировано Национальным комитетом по клиническим лабораторным стандартам США (NCCLS, document NRSCL 8 -A). Близко к употребляемому у нас термину «лабораторный показатель» , «параметр» , «тест» и др.
Методы оценки состояния системы биотранс- формации ксенобиотиков: 1) Высокоэффективная жидкостная хроматография (ВЭЖХ). Дает возможность исследовать аналиты в моче, крови, слюне, другом биологическом материале после введения ксенобиотика (лекарственного вещества). Можно проводить кинетический анализ, позволяющий определить период полувыведения тестового препарата, объем кажущегося распределения, клиренс элиминации, исследовать другие параметры. Аналит – это компонент или характеристика образца, подлежащий (ая) измерению. Это понятие включает в себя любой элемент: ион, соединение, вещество, фактор, инфекционный агент, клетку, органеллу, активность (ферментативную, гормональную, иммунологическую) или признак: наличие или отсутствие, концентрацию, активность, интенсивность или другие характеристики, которые необходимо определить. Понятие сформулировано Национальным комитетом по клиническим лабораторным стандартам США (NCCLS, document NRSCL 8 -A). Близко к употребляемому у нас термину «лабораторный показатель» , «параметр» , «тест» и др.
 2) ПЦР-ПДРФ анализ полиморфизма и мутантных форм генов цит. Р-450. W; Результаты анализа полиморфизма длины рестрикционных фрагментов (ПДРФ-анализ) гена CYP 1 A 2: 1 – маркер молекулярных масс; 2, 4, 6, 7, 8, 10 и 11 – мутантный генотип – M (мутация в сайте рестрикции – рестрикция не происходит); 3 – мутация отсутствует – генотип дикого типа – 5 и 9 – гетерозиготный генотип – имеются все фрагменты – H; 12 – отрицательный контроль.
2) ПЦР-ПДРФ анализ полиморфизма и мутантных форм генов цит. Р-450. W; Результаты анализа полиморфизма длины рестрикционных фрагментов (ПДРФ-анализ) гена CYP 1 A 2: 1 – маркер молекулярных масс; 2, 4, 6, 7, 8, 10 и 11 – мутантный генотип – M (мутация в сайте рестрикции – рестрикция не происходит); 3 – мутация отсутствует – генотип дикого типа – 5 и 9 – гетерозиготный генотип – имеются все фрагменты – H; 12 – отрицательный контроль.
 3) ДНК-чипы Позволяют одновременно определять очень большое количество полиморфизмов в одной пробе. На твердом чипе очень небольшого размера в виде отдельных пятен размещается большое количество олигонуклеотидных зондов, каждый из которых обеспечивает специфическую гибридизацию с нормальными и мутантными аллелями множества различных генов. Перед проведением гибридизации проводят неспецифическое флуоресцентное мечение исследуемой ДНК. В случае связывания ДНК образца с зондом на чипе выявляется флуоресцентный сигнал соответствующего участка чипа [Иванов, Терешин, Щербак, 2010]. Зная, какая аллель отвечает за синтез того или иного изофермента цит. Р-450, можно определить какие ксенобиотики и каким путем будут биотрансформированы.
3) ДНК-чипы Позволяют одновременно определять очень большое количество полиморфизмов в одной пробе. На твердом чипе очень небольшого размера в виде отдельных пятен размещается большое количество олигонуклеотидных зондов, каждый из которых обеспечивает специфическую гибридизацию с нормальными и мутантными аллелями множества различных генов. Перед проведением гибридизации проводят неспецифическое флуоресцентное мечение исследуемой ДНК. В случае связывания ДНК образца с зондом на чипе выявляется флуоресцентный сигнал соответствующего участка чипа [Иванов, Терешин, Щербак, 2010]. Зная, какая аллель отвечает за синтез того или иного изофермента цит. Р-450, можно определить какие ксенобиотики и каким путем будут биотрансформированы.
 4) Компьютерные программы для моделирования взаимодействия лигандов с цитохромами Р 450 Для изучения взаимодействия субстрата и фермента используются методы молекулярного докинга и молекулярной динамики. Молекулярный докинг (или молекулярная стыковка) - это метод молекулярного моделирования, который позволяет предсказать наиболее выгодную для образования устойчивого комплекса ориентацию и положение одной молекулы по отношению к другой. При помощи скоринговых функций (англ. score - счет), определяют наиболее энергетически выгодные конформации лиганда в активном центре. Молекулярная динамика - метод, в котором временная эволюция системы взаимодействующих атомов или частиц отслеживается интегрированием их уравнений движения. Играет важную роль (наряду с кристаллографией и ЯМР) в определении структуры белка и уточнении его свойств. Наиболее популярными пакетами программного обеспечения для моделирования динамики биологических молекул являются: AMBER, CHARMM (и коммерческая версия CHARMMm), GROMACS, GROMOS, Lammhs, HOOMD-blue, NAMD.
4) Компьютерные программы для моделирования взаимодействия лигандов с цитохромами Р 450 Для изучения взаимодействия субстрата и фермента используются методы молекулярного докинга и молекулярной динамики. Молекулярный докинг (или молекулярная стыковка) - это метод молекулярного моделирования, который позволяет предсказать наиболее выгодную для образования устойчивого комплекса ориентацию и положение одной молекулы по отношению к другой. При помощи скоринговых функций (англ. score - счет), определяют наиболее энергетически выгодные конформации лиганда в активном центре. Молекулярная динамика - метод, в котором временная эволюция системы взаимодействующих атомов или частиц отслеживается интегрированием их уравнений движения. Играет важную роль (наряду с кристаллографией и ЯМР) в определении структуры белка и уточнении его свойств. Наиболее популярными пакетами программного обеспечения для моделирования динамики биологических молекул являются: AMBER, CHARMM (и коммерческая версия CHARMMm), GROMACS, GROMOS, Lammhs, HOOMD-blue, NAMD.
 При описании взаимодействия цит. Р-450 и лигандов оценивается роль пространственных и энергетических факторов, т. к. вклад этих факторов для различных цит. Р 450 отличается. Для исчерпывающего описания взаимодействия низкомолекулярного лиганда и цит. Р-450 in silico и предсказания возможных биотрансформаций необходимо учитывать: § реакционную способность фермента, § структуру активного центра фермента, § расположение и конформацию лиганда в активном центре фермента, § возможность множественных способов связывания субстрата в активном центре фермента (связывание может происходить опосредованно через молекулы воды), § региоспецифичную реакционную способность, присущую самому субстрату (она может меняться в зависимости от конформации, принимаемой субстратом), § аффинность продукта, который должен высвободиться из активного центра фермента.
При описании взаимодействия цит. Р-450 и лигандов оценивается роль пространственных и энергетических факторов, т. к. вклад этих факторов для различных цит. Р 450 отличается. Для исчерпывающего описания взаимодействия низкомолекулярного лиганда и цит. Р-450 in silico и предсказания возможных биотрансформаций необходимо учитывать: § реакционную способность фермента, § структуру активного центра фермента, § расположение и конформацию лиганда в активном центре фермента, § возможность множественных способов связывания субстрата в активном центре фермента (связывание может происходить опосредованно через молекулы воды), § региоспецифичную реакционную способность, присущую самому субстрату (она может меняться в зависимости от конформации, принимаемой субстратом), § аффинность продукта, который должен высвободиться из активного центра фермента.
 Р-ция наз. региоспецифичной, если в качестве единств. продукта (в пределах ошибки) образуется один из двух или нескольких возможных регио-изомеров. Региоизомеры – это изомеры, образующиеся в результате преобразования одного из нескольких возможных реакционных центров, имеющихся в молекуле субстрата. Если один изомер лишь преобладает в продуктах р -ции, такая р-ция наз. региоселективной. Напр. , присоединение несимметричного электрофильного НВг к несимметричному стиролу С 6 Н 5 СН=СН 2 происходит региоспецифично: образуется только один из двух возможных продуктов присоединения – С 6 Н 5 СНВr. СН 3, но не С 6 Н 5 СН 2 Вr.
Р-ция наз. региоспецифичной, если в качестве единств. продукта (в пределах ошибки) образуется один из двух или нескольких возможных регио-изомеров. Региоизомеры – это изомеры, образующиеся в результате преобразования одного из нескольких возможных реакционных центров, имеющихся в молекуле субстрата. Если один изомер лишь преобладает в продуктах р -ции, такая р-ция наз. региоселективной. Напр. , присоединение несимметричного электрофильного НВг к несимметричному стиролу С 6 Н 5 СН=СН 2 происходит региоспецифично: образуется только один из двух возможных продуктов присоединения – С 6 Н 5 СНВr. СН 3, но не С 6 Н 5 СН 2 Вr.
 QSAR модели. Количественные взаимоотношения структура-активность (QSAR - англ. сокр. от Quantitative Structure-Activity Relationships) позволяют по описанию структуры химических соединений предсказывать их свойства, в том числе устанавливать взаимодействие с цитохромами низкомолекулярных соединений и их биотрансформацию. Например: 1) для классификации субстратов различных цитохромов применяются: метод построения опорных векторов, метод К-ближайших соседей, метод дерева принятия решений и др. 2) для оценки взаимодействия лигандов, (субстратов и ингибиторов) с активным центром цитохрома используются трехмерные QSAR (3 -D QSAR) методы.
QSAR модели. Количественные взаимоотношения структура-активность (QSAR - англ. сокр. от Quantitative Structure-Activity Relationships) позволяют по описанию структуры химических соединений предсказывать их свойства, в том числе устанавливать взаимодействие с цитохромами низкомолекулярных соединений и их биотрансформацию. Например: 1) для классификации субстратов различных цитохромов применяются: метод построения опорных векторов, метод К-ближайших соседей, метод дерева принятия решений и др. 2) для оценки взаимодействия лигандов, (субстратов и ингибиторов) с активным центром цитохрома используются трехмерные QSAR (3 -D QSAR) методы.
 Суперсемейство цит. Р-450 катализирует большое количество реакций, проходящих по разным механизмам, поэтому классические QSAR методы не могут быть применены корректно для веществ, принадлежащих к различным классам. Для каждого отдельного цитохрома, метаболизирующего ксенобиотик, нужно строить специальную QSAR модель с использованием различных дескрипторов и разных математических методов.
Суперсемейство цит. Р-450 катализирует большое количество реакций, проходящих по разным механизмам, поэтому классические QSAR методы не могут быть применены корректно для веществ, принадлежащих к различным классам. Для каждого отдельного цитохрома, метаболизирующего ксенобиотик, нужно строить специальную QSAR модель с использованием различных дескрипторов и разных математических методов.
 Основные цитохромы Р 450, ответственные за метаболизм лекарств в организме человека исследуемые in silico – это подсемейство цит. Р-450 3 А. Цитохром Р 450 ЗА 4 является мембраносвязанным белком, расположен в эндоплазматическом ретикулуме. Молекулярная масса 57299 D, в первичной структуре содержится 502 аминокислотных остатка. Ген CYP 3 A 4 расположен в длинном плече седьмой хромосомы (7 q 22. 1). Подсемейство ЗА – наиболее экспрессируемое в печени и кишечнике. Примерно 2/3 цитохромов печени принадлежат к этому подсемейству. Два цит. Р 450 ЗА 4 и 3 А 5 подробно описаны в литературе. Цит. Р 450 ЗА 5 чаще встречается у подростков, полиморфно экспрессируемый и не индуцируемый глюкокортикоидами, в отличие от ЗА 4. Существует еще одна эмбрионально экспрессируемая изоформа - ЗА 7 (составляет 50 % фетальных цитохромов Р 450).
Основные цитохромы Р 450, ответственные за метаболизм лекарств в организме человека исследуемые in silico – это подсемейство цит. Р-450 3 А. Цитохром Р 450 ЗА 4 является мембраносвязанным белком, расположен в эндоплазматическом ретикулуме. Молекулярная масса 57299 D, в первичной структуре содержится 502 аминокислотных остатка. Ген CYP 3 A 4 расположен в длинном плече седьмой хромосомы (7 q 22. 1). Подсемейство ЗА – наиболее экспрессируемое в печени и кишечнике. Примерно 2/3 цитохромов печени принадлежат к этому подсемейству. Два цит. Р 450 ЗА 4 и 3 А 5 подробно описаны в литературе. Цит. Р 450 ЗА 5 чаще встречается у подростков, полиморфно экспрессируемый и не индуцируемый глюкокортикоидами, в отличие от ЗА 4. Существует еще одна эмбрионально экспрессируемая изоформа - ЗА 7 (составляет 50 % фетальных цитохромов Р 450).
 Цитохром b 5 – гемопротеин, участвует в разнообразных биохимических окислительно-восстановительных реакциях в качестве переносчика электронов. Молекула микросомального цитохрома b 5 состоит из двух доменов - гидрофильного и гидрофобного. Гидрофильный N-концевой участок расположен на поверхности мембраны ЭР, образован аминокислотными остатками с 1 -88, содержит гем, входящий в состав активного центра. Схематичное изображение расположения молекулы цитохрома b 5 в мембране.
Цитохром b 5 – гемопротеин, участвует в разнообразных биохимических окислительно-восстановительных реакциях в качестве переносчика электронов. Молекула микросомального цитохрома b 5 состоит из двух доменов - гидрофильного и гидрофобного. Гидрофильный N-концевой участок расположен на поверхности мембраны ЭР, образован аминокислотными остатками с 1 -88, содержит гем, входящий в состав активного центра. Схематичное изображение расположения молекулы цитохрома b 5 в мембране.
 Гидрофобный домен цитохрома b 5 заякорен в липидном бислое (ЭПР или митохондриальной), спирализован, образован остатками аминокислот C- конца белковой молекулы (остатки аминокислот 89 -133). С помощью компьютерного моделирования показано, что С -концевой участок молекулы цитохрома b 5 образует петлю и пронизывает липидную мембрану насквозь. Наибольшая гидрофобность наблюдается в средней части петли, которая погружена в мембрану. С-концевая часть молекулы фермента играет важную роль при встраивании в мембрану, ориентации энзима в липидном бислое, обеспечении функциональной активности.
Гидрофобный домен цитохрома b 5 заякорен в липидном бислое (ЭПР или митохондриальной), спирализован, образован остатками аминокислот C- конца белковой молекулы (остатки аминокислот 89 -133). С помощью компьютерного моделирования показано, что С -концевой участок молекулы цитохрома b 5 образует петлю и пронизывает липидную мембрану насквозь. Наибольшая гидрофобность наблюдается в средней части петли, которая погружена в мембрану. С-концевая часть молекулы фермента играет важную роль при встраивании в мембрану, ориентации энзима в липидном бислое, обеспечении функциональной активности.
 Цитохром b 5 наружной мембраны митохондриий, по сравнению с микросомальным обладает более низким редокспотенциалом, молекула более устойчива к химической и термической денатурации, связь между апопротеином и гемом значительно прочнее. В молекуле цитохрома b 5 митохондрий выявлено два гидрофобных участка. Первый формируют остатки аланина-18, изолейцина-32, лейцина-36 и лейцина-47. Второй – изолейцин 25, фенилаланин-58, лейцин-71 и гем. С использованием мутантных форм молекулы показано, что оба гидрофобных участка имеют большое значение в поддержании стабильности молекулы. При отсутствии или замены в них аминокислотных остатков взаимодействие апопротеина с гемом снижается.
Цитохром b 5 наружной мембраны митохондриий, по сравнению с микросомальным обладает более низким редокспотенциалом, молекула более устойчива к химической и термической денатурации, связь между апопротеином и гемом значительно прочнее. В молекуле цитохрома b 5 митохондрий выявлено два гидрофобных участка. Первый формируют остатки аланина-18, изолейцина-32, лейцина-36 и лейцина-47. Второй – изолейцин 25, фенилаланин-58, лейцин-71 и гем. С использованием мутантных форм молекулы показано, что оба гидрофобных участка имеют большое значение в поддержании стабильности молекулы. При отсутствии или замены в них аминокислотных остатков взаимодействие апопротеина с гемом снижается.
 Роль цитохрома b 5 в реакциях, катализируемых изоформами системы цитохрома Р-450. Возможные механизмы стимулирующего влияния цит. b 5 на изоформы цит. Р-450: прямая передача электрона в монооксигеназной реакции, без посредства НАДФ цитохром Р-450 редуктазы; в случае использования второго электрона от цитохрома b 5 в монооксигеназном цикле происходит образование более активных радикалов кислорода, что, в свою очередь, сопровождается более быстрым образованием метаболита;
Роль цитохрома b 5 в реакциях, катализируемых изоформами системы цитохрома Р-450. Возможные механизмы стимулирующего влияния цит. b 5 на изоформы цит. Р-450: прямая передача электрона в монооксигеназной реакции, без посредства НАДФ цитохром Р-450 редуктазы; в случае использования второго электрона от цитохрома b 5 в монооксигеназном цикле происходит образование более активных радикалов кислорода, что, в свою очередь, сопровождается более быстрым образованием метаболита;
 цит. b 5 взаимодействует с цит. Р-450 с образованием комплекса двух гемопротеинов и последующей передачей двух электронов от НАДФН цитохром Р-450 редуктазы. Это повышает скорость образования активного кислорода и устраняет необходимость повторного взаимодействия цит. Р-450 и НАДФН цитохром Р-450 редуктазы; цит. b 5 может осуществлять аллостерическую стимуляцию цит. Р- 450 без переноса электронов, например на втором этапе каталического цикла; цитохром b 5 может оказывать защитное действие на молекулы терминальной оксигеназы, которое не связано с реакциями окислительно-восстановительного цикла, что предотвращет ее разрушение.
цит. b 5 взаимодействует с цит. Р-450 с образованием комплекса двух гемопротеинов и последующей передачей двух электронов от НАДФН цитохром Р-450 редуктазы. Это повышает скорость образования активного кислорода и устраняет необходимость повторного взаимодействия цит. Р-450 и НАДФН цитохром Р-450 редуктазы; цит. b 5 может осуществлять аллостерическую стимуляцию цит. Р- 450 без переноса электронов, например на втором этапе каталического цикла; цитохром b 5 может оказывать защитное действие на молекулы терминальной оксигеназы, которое не связано с реакциями окислительно-восстановительного цикла, что предотвращет ее разрушение.
 Влияние цит. b 5 на изменение скорости реакции, спектра метаболитов и образование активных форм кислорода в реакциях системы цит. Р-450. в присутствии цит. b 5 скорость метаболизма большинства эндогенных соединений и ксенобиотиков чаще всего повышается; влияние цит. b 5 на биотрансформацию одного и того же соединения, например андростендиона, у разных видов животных неодинаково. У кроликов в присутствии цит b 5 скорость метаболизма стероида цит. Р-450 2 В 5 повышается, а у собак – цит. Р-450 2 В 11 снижается;
Влияние цит. b 5 на изменение скорости реакции, спектра метаболитов и образование активных форм кислорода в реакциях системы цит. Р-450. в присутствии цит. b 5 скорость метаболизма большинства эндогенных соединений и ксенобиотиков чаще всего повышается; влияние цит. b 5 на биотрансформацию одного и того же соединения, например андростендиона, у разных видов животных неодинаково. У кроликов в присутствии цит b 5 скорость метаболизма стероида цит. Р-450 2 В 5 повышается, а у собак – цит. Р-450 2 В 11 снижается;
 цит. b 5 у разных видов (человек и хомячок) может не изменять скорости окисления соединения (нитрозамин) или оказывать стимулирующее действие; наличие цит. b 5 изменяет спектр метаболитов, образующихся при биотринсформации соединения одной и той же изоформой цит. Р-450, например тетрахлорбифенила цит. Р-450 2 В 1; в присутствии цит. b 5 уменьшается образование активных форм кислорода, гиперпродукция которых оказывает негативное действие на жизнедеятельность клеток организма; метаболизм биологически активных соединений (арахидоновая кислота, лейкотриены) происходит только в присутствии цит. b 5.
цит. b 5 у разных видов (человек и хомячок) может не изменять скорости окисления соединения (нитрозамин) или оказывать стимулирующее действие; наличие цит. b 5 изменяет спектр метаболитов, образующихся при биотринсформации соединения одной и той же изоформой цит. Р-450, например тетрахлорбифенила цит. Р-450 2 В 1; в присутствии цит. b 5 уменьшается образование активных форм кислорода, гиперпродукция которых оказывает негативное действие на жизнедеятельность клеток организма; метаболизм биологически активных соединений (арахидоновая кислота, лейкотриены) происходит только в присутствии цит. b 5.
 Влияние цитохрома b 5 на изменение скорости реакции, спектра метаболитов и образование активных форм кислорода в реакциях при участии различных изоформ цит. Р-450 (фрагмент) Изоформа цитохрома Р-450 Субстрат Изменение скорости реакции Р-450 1 А 1 тетрахлорбифенил П Р-450 2 А 1 Р-450 2 В 1 Андростендион П - II - П Р-450 2 В 2 2 -хлор-1, 1 дифлуороэтина тетрахлорбифенил (2, 2", 5, 5"- и 2, 3", 4", 5 -) тетрахлорбифенил (2, 3, 4, 4 -) 9 -антралдегид Р-450 2 В 4 Тетранитрометан Н - II - Aминопирин П Андростендион П Тестостерон не изменяет Образование активных форм кислорода ↓ метанол, 7 -этоксикумарин 9 -антралдегид Изменение спектра метаболитов Р-450 1 А 2 - II - Р-450 2 В 5 - II - ↓ П П изменяется ↓ изменяется П изменяется
Влияние цитохрома b 5 на изменение скорости реакции, спектра метаболитов и образование активных форм кислорода в реакциях при участии различных изоформ цит. Р-450 (фрагмент) Изоформа цитохрома Р-450 Субстрат Изменение скорости реакции Р-450 1 А 1 тетрахлорбифенил П Р-450 2 А 1 Р-450 2 В 1 Андростендион П - II - П Р-450 2 В 2 2 -хлор-1, 1 дифлуороэтина тетрахлорбифенил (2, 2", 5, 5"- и 2, 3", 4", 5 -) тетрахлорбифенил (2, 3, 4, 4 -) 9 -антралдегид Р-450 2 В 4 Тетранитрометан Н - II - Aминопирин П Андростендион П Тестостерон не изменяет Образование активных форм кислорода ↓ метанол, 7 -этоксикумарин 9 -антралдегид Изменение спектра метаболитов Р-450 1 А 2 - II - Р-450 2 В 5 - II - ↓ П П изменяется ↓ изменяется П изменяется
 НАДН-цитохром b 5 -редуктаза – флавопротеин. Это двухдоменный белок, глобулярный цитозольный домен связывает ФАД, гидрофобный домен (единственный «хвост») закрепляет белок в мембране.
НАДН-цитохром b 5 -редуктаза – флавопротеин. Это двухдоменный белок, глобулярный цитозольный домен связывает ФАД, гидрофобный домен (единственный «хвост») закрепляет белок в мембране.
Драпкина О.М.
i>Академик Ивашкин В.Т.: – Оксана Михайловна, у Вас есть возможность выступить со своим сообщением «Цитохром Р450 и фармакокинетика лекарственных средств». Пожалуйста!
Профессор Драпкина О.М.: – Мне сегодня выпало говорить о цитохроме Р450 и о межлекарственных возможных взаимодействиях. И, в основном, я буду, сразу скажу, касаться вопроса взаимодействия ингибиторов протонной помпы и клопидогреля. Много публикаций на эту тему. В общем-то, все равно не до конца все ясно, но я попробую представить свою точку зрения на эту проблему.
Итак, если мы говорим о лекарственных взаимодействиях, то мы можем или должны сначала, по-видимому, дать определение, что лекарственные взаимодействия – это изменение фармакологического эффекта одного или нескольких лекарственных средств (ЛС) при одновременном или последовательном их применении.
И как вообще в жизни все взаимодействия можно разделить, так же и лекарственные взаимодействия, на:
- сенситизирующее действие;
- аддитивное действие;
- те моменты, когда происходит суммация действия;
- и потенцирование эффектов.
Это все относится к классу синергизма, когда происходит содружественная реакция лекарственных средств, или антагонизм.
Виды лекарственных взаимодействий также делятся согласно клинической фармакокинетике на:
– фармацевтические, что подразумевает различные взаимодействия вне организма;
– фармакокинетические – это изменение фармакокинетических характеристик лекарственных веществ;
– фармакодинамические, когда происходит изменение одного из применяемых препаратов.
Все препараты, которые применяет наш пациент, которые мы с вами применяем, проходят один и тот же путь. Это две фазы.
I фаза – это фаза окисления. И как раз здесь большую роль, или основную роль берет на себя система цитохрома Р450.
И II фаза, в которой тоже можно выделить несколько таких подфаз, заканчивающихся метилированием и конъюгацией с различными веществами, представленными на слайде.
Надо сказать, что система цитохрома Р450 – это система очень сложно устроенная, это система микросомального окисления. Если, или благодаря, этой системе мы продолжаем жить и живем долго, и стремимся к тому, чтобы наши пациенты жили долго, поскольку основной путь детоксикации и метаболизма лекарственных средств, и, кроме того, это основной путь и основная возможность сделать вещества растворимыми и вывести их из организма.
Основная локализация – печень, хотя эта система представлена в некоторых других органах. И, как я уже сказала, основная задача – это сделать сложноустроенные системы, сделать вещества менее токсичными и лучше растворимыми для того, чтобы они вывелись почками.
Я попытаюсь коротко проиллюстрировать, как же работает цитохром Р450. Это мощная система. Она настолько мощна, что она может разорвать атом кислорода, т.е. О 2 , разделить его на два электрона, и один электрон вставить в ксенобиотик, или в препарат, который плохо растворим. Так вот, у нас есть плохо растворимое вещество, или ксенобиотик, есть кислород О 2 , и есть универсальный восстановитель НАДФ + Н + . Вот этот Н + нужен тоже для того, чтобы был дан дополнительный протон. И в результате трансформации через систему цитохрома Р450 мы видим, что в результате этой реакции образуется вода, окисленный восстановитель НАДФ и уже ксенобиотик, в которой встроен протон и электрон кислорода. Этот ксенобиотик уже может выводиться, будучи растворимым веществом.
Основную работу в этом большом семействе, состоящем из различных изоформ цитохрома Р450, конечно, основная работа приходится на CYP3А4, это практически 34%. Но я сегодня в большей степени остановлюсь на той изоформе, которая отвечает за 8% метаболизма и ингибитора протонной помпы, в большинстве своем тоже метаболизируется тоже с помощью цитохрома и его изоформы CYP2С19. Он тоже метаболизируется с помощью цитохрома и его изоформы CYP2C19.
Его особенности таковы, что он составляет немного, всего лишь около 1% от пула цитохромов печени, при этом, как было показано в предыдущем слайде, он метаболизирует около 8% лекарственных препаратов. Для него характерен генетический полиморфизм и его метаболизм изучен, в основном, на омепразоле, поэтому два последующих слайда, они будут представлять кинетику и превращение омепразола. Изученные есть работы с другими субстратами, которые представлены на данном слайде. Но вот для нашей клиники, конечно, наибольший интерес представляет метаболизм варфарина, поскольку таких пациентов становится все больше с фибрилляцией предсердий, пропранолола и ингибиторов протонной помпы.
Итак, мы можем сказать, или смоделировать ситуацию, что есть три возможных схемы межлекарственных взаимодействий.
Первая – когда лекарство и второе лекарство, которое, является индуктором цитохрома (например, фенобарбитал) приводят к ускорению метаболизма и уменьшению времени жизни в плазме крови вот того лекарства, которое изображено первым на данном слайде.
Вторая ситуация – когда к лекарству или с лекарством вместе употребляет человек ингибитор цитохрома (например, фторхинолоны). Это приводит к замедлению метаболизма и увеличению времени «жизни» в плазме крови.
Есть и такая ситуация, когда два лекарства метаболизируются в одной и той же изоформе системы CYP цитохрома Р450, лекарство 1 и лекарство 2, и в таком случае происходит замедление метаболизма обоих лекарств. Вот именно такую схему сегодня в большей степени я и рассмотрю.
Я уже сказала, что цитохром Р450 CYP2C19, его маркерный агент – омепразол, и поэтому очень хорошо изучено влияние омепразола на систему цитохрома Р450. Известно, что он ингибирует, что он индуцирует и метаболизируется.
Есть разные омепразолы. Мы знаем правовращающие и левовращающие. Но на самом деле, несмотря на множество публикаций о том, что левовращающие изомеры обладают несколько другими свойствами и несколько другим метаболизмом. Цитохром Р450, а именно изоформа CYP2C19 повинна и в том, и в другом случае метаболизма омепразола – и правовращающего, и левовращающего изомера, который мы знаем под названием эзомепразол.
Как я уже сказала, вклад генетических полиморфизмов важен. Это приблизительно 3% населения. Это приводит к тому, что концентрация омепразола увеличивается в плазме крови, и, соответственно, чем больше концентрация омепразола, тем больше риск лекарственных взаимодействий, например, с клопидогрелем, который также метаболизируется системой цитохрома Р450 именно изоформой CYP2C19.
Последние исследования доказали, что жизнь человека с острым коронарным синдромом тоже может зависеть от активности этого цитохрома, поэтому более тяжелый прогноз и более высокий риск тромбоза стента повторных инфарктов миокарда имеют люди со сниженным метаболизмом цитохрома Р450. В европеоидной расе это приблизительно 2%, и чуть больше таких медленных метаболизаторов у монголоидов.
Если теперь коснуться фармакокинетики клопидогрела, то тоже мы знаем, что это неактивное вещество, и для того, чтобы превратиться в активное тиольное производное клопидогрела, необходимо клопидогрелу к вот этому неактивному веществу пройти путь через печень, через систему CYP2C19, превращаясь на промежуточном этапе в 2-оксо-клопидогрел. И уже потом вот это тиольное производное может необратимо связываться с рецепторами на тромбоцитах, АТФ индуцированными.
Таким образом, получается, что фармакодинамическое взаимодействие клопидогреля, которое было проиллюстрировано несколько слайдов раньше, зависит не только от того, что нагружается одна и та же изоформа цитохрома, но и от дозы. Чем больше, например, доза омепразола или другого ингибитора протонной помпы, тем меньше доза активного метаболита клопидогреля, соответственно, тем больше риск развития тромбозов у данных пациентов.
Возникает вопрос: что делать? Можно не применять клопидогрел, например, у пациентов. Или стоит заменить клопидогрел аспирином. Можно не применять омепразол или заменить омепразол другими ингибиторами протонной помпы (ИПП). Мне кажется, на первые два вопроса, особенно, на первый вопрос, мы ответим отрицательно. Заменить или не применять клопидогрел невозможно, потому что статистика говорит о том, что стентов устанавливается все больше, ишемических болезней сердца с различными осложнениями тоже много. Поэтому все данные, вот одно из исследований – исследование CURE, показало, что все-таки применение двухкомпонентной тромбоцитарной терапии (клопидогрел + аспирин) снижает риск развития острого инфаркта миокарда на 31%. Такие же, или похожие данные были в исследовании АКАПРИ, когда было показано в самом начале, что клопидогрел настолько же эффективен, как и аспирин.
Второй вопрос: возможно ли клинически значимое взаимодействие между ИПП и аспирином? Оказывается, в 2011 году вышла работа, которая показала, что и между аспирином, и между ингибиторами протонной помпы тоже возможны клинические взаимодействия. И данное исследование продемонстрировало, что около 50 000 пациентов с острым инфарктом миокарда, если они принимали ИПП, риск острого инфаркта миокарда возрастал на 46%.
И, наконец, клопидогрел. Считается, особенно после исследования АКАПРИ, что клопидогрель столько же эффективен и как будто более безопасен. Но, тем не менее, даже эта чуть большая безопасность все равно ассоциируется в то, что есть риск развития гастродуоденальных язв. Риск особенно возрастает при комбинированном приеме клопидогреля и аспирина, в 7 раз он выше. И, соответственно, ИПП безусловно здесь могут помочь.
Целесообразность профилактического назначения ингибиторов протонной помпы доказана во многих исследованиях. Вот тоже статистика. ИПП на фоне применения нестероидных противовоспалительных препаратов снижает на 37% желудочно-кишечные кровотечения. И мы видим, что и низкие дозы аспирина у пациентов, которые мы, грубо говоря, прикрывали ингибиторами протонной помпы, также снижают риск кровотечений в среднем где-то на треть.
Таким образом, рекомендации, которые нам сейчас даются, говорят о том, что ИПП (не омепразол) показаны больным с установленными стентами в коронарные артерии, получающими клопидогрель, которые старше 65 лет, у которых в анамнезе была язвенная болезнь и которые имеют другие факторы повышенного риска желудочно-кишечных кровотечений. Это, собственно говоря, та шкала CRUSADE, о которой сегодня говорил профессор Затейщиков. Было проведено много мета-анализов. И на самом деле сейчас в рекомендациях тоже это отдано на желание врача, какой ИПП выбрать, но, тем не менее, все-таки те приведенные на данном слайде мета-анализы говорят о том, что все-таки ИПП снижают активность клопидогреля и в меньшей степени влияют на кинетику цитохрома Р450 CYP2C19, именно рабепразол и пантопразол.
Эффект взаимодействия отмечен во многих работах. Я собрала несколько из них. Первое – исследование на 26 пациентах сначала это было, клопидогрел в нагрузочной дозе вместе с лансопразолом, приводило к тому, что концентрация клопидогреля снижалась на 13%.
Другое перспективное исследование – больные (их уже 300) с острым коронарным синдромом, после ангиопластики, клопидогрел с пантопразолом – статистически недостоверное уменьшение эффекта клопидогрела на тромбоциты.
И, наконец, ретроспективное исследование, пациентов – более 16 000, которые перенесли ангиопластику, клопидогрел с ИПП – тоже показало повышение риска достижения комбинированной конечной точки.
Следующее исследование – достаточно знаменитое исследование Ho и соавторов , тоже ретроспективное когортное исследование, пациенты с острым коронарным синдромом. За ними следили 3 года. В течение 3-х лет они получали клопидогрел. Было отмечено повышение смертности и повторные ОКС, т.е. инфаркты миокарда, в группе пациентов, которые получали ИПП вместе с клопидогрелем, на 25%.
В Канаде эти данные тоже получили подтверждение. Более 13 000 пациентов с ОКС. Повышение смертности было отмечено на фоне применения клопидогреля совместно с ИПП (это был омепразол) на 40%. Исключение составили больные, которые получали рабепразол и пантопразол, которые в меньшей степени влияли на CYP2C19, а также на фоне Н 2 -блокаторов тоже не было отмечено повышение смертности.
Кроме того, были работы, которые показывали изменения функции тромбоцитов, подавление функции тромбоцитов, на фоне применения клопидогреля вместе с аспирином и затем к этой комбинации добавлялся омепразол. Так вот у этих пациентов, которые получали омепразол, к 7-му дню отмечалось значительное повышение реактивности тромбоцитов. Таким образом, рабепразол и пантопразол – это те препараты, на мой взгляд, которые должны применяться пациентами с двойной антитромбоцитарной терапией.
И тоже несколько подтверждений. Исследование Sharara, которое решило поставить целью посмотреть: клопидогрель с рабепразолом или же клопидогрель с эзопразолом влияет ли на антиагрегантные свойства. Оказалось, что процент пациентов, у которых изменялась вазореактивность, был больше именно в группе клопидогреля с омепразолом.
И следующее исследование, последнее, на котором я остановлюсь. Исследователи поставили цель посмотреть влияние рабепразола на антиагрегантные свойства клопидогреля. Мы знаем рабепразол, как препарат париет, оценивающийся в нашей клинической практике. Оценивался индекс реактивности тромбоцитов. И оказалось, когда посмотрели, сравнили группу с плацебо, группу с омепразолом и группу с рабепразолом, что изменений нет, т.е. изменения статистически недостоверны. Однако когда посмотрели и оценили пациентов, которые ответили хорошо на терапию клопидогрелем, оказалось, что в группе рабепразола вот это вот изменение индекса реактивности тромбоцитов было практически таким же, как в плацебо. А вот в омепразоле это было – 43,2%. Маленькая цифра (–47,3% и –43,2%), однако она имела статистически достоверную характеристику, что говорило о том, что в группе омепразола действительно индекс реактивности тромбоцитов изменен.
Таким образом, если к нам поступает пациент с двойной тромбоцитарной терапией, то в первую очередь следует оценить риск действия нестероидных противовоспалительных средств и антитромбоцитарных препаратов. Мы их делим на пациентов высокого риска, умеренного риска и низкого риска, когда нет факторов риска. Итак, высокий риск. Осложненная язва в анамнезе, множественные факторы риска. Умеренный риск – это возраст старше 65 лет, высокая доза НПВС.
И соответственно, резюмируя все эти рекомендации, я предлагаю такую схему. ИПП при приеме антитромбоцитарных средств, еще раз хочу сказать – рабепразол, париет, назначать стоит всем больным с анамнезом язвенных осложнений, без кровотечения, лицам с анамнезом желудочно-кишечного кровотечения, всем тем, кто в данный момент получает двойную антитромбоцитарную терапию, сопутствующую антикоагулянтную терапию и имеет один из факторов риска, например, возраст, лечение ГКС или имеющие проявления гастроэзофагиальной рефлюксной болезни.
Что такое – пациент XXI столетия? В основном мы имеем дело с пациентами старше 65 лет. И вот что представляет из себя этот пациент? У этого пациента заблокировано практически все, что только можно заблокировать. С помощью блокаторов кальциевых каналов, и бета-блокаторов, и средств, влияющих на ренин-ангиотензин-альдостероновую систему, мы заблокировали соответствующие рецепторы. Аспирин и клопидогрел – это циклооксигеназа и тромбоциты, тоже заблокированы. Не дай Бог, если эти пациенты еще тучные, и не дай Бог, если он применяет препараты, которые снижают уровень орлистата (ингибитор панкреатической липазы). ГМК-КоА-редуктаза с помощью розувастатина тоже заблокирована, метформином заблокирована. Поэтому более 50 пациентов, которые приходят к нам старше 6о лет, принимают более 5 препаратов. Соответственно, лекарственные взаимодействия здесь неизбежны. И конечно, в этом случае лучше выбрать то лекарственное средство, которое не будет или будет в меньшей степени вмешиваться в работу цитохрома Р450. И поэтому в этом течении между Сциллой и Харибдой у пациента с двойной антитромбоцитарной терапией или даже с одинарной тромбоцитарной терапией с одной стороны – язва и кровотечения, с другой стороны – уменьшение коронарных событий, наверно, помощь может составить рабепразол (париет). Спасибо за внимание!
| (0) |
Нашу жизнь невозможно представить без лекарств. Стоит заболеть голове или заколоть в боку-мы тут же хватаемся за наш любимый цитрамон или дротаверин. Очень редко мы задумываемся о том, что же происходит в нашем организме с препаратами, поступившими внутрь и каким безопасным образом эти лекарства нейтрализуются и выводятся из организма, после того как они выполнили свою основную функцию.
Как показали филогенетические исследования, цитохромы Р- 450 появились в живых организмах более трёх миллиардов лет назад.
Исследованиями структуры и формы цитохромов занимались P. Williams, благодаря её работе была расшифрована структура изоформы 2С5 цитохрома Р450 у кролика. В компания «Astex» она в дальнейшем продолжила свою работу по исследованию цитохромов, но уже человека. В 2001 году была расшифрована структура цит 2С9 человека. А также компания «Astex» представила информацию о структуре цит 3А4, который метаболизирует очень многие лекарственные препараты, применяемые повсеместно.
Итак, основным органом, который превращает липофильные лекарственные препараты в гидрофильный метаболит, является печень. Препарат попадает в гепатоцит путем активного либо пассивного транспорта, где под влиянием ферментов-цитохрома Р450 он проходит ряд превращений. . Процесс метаболизма протекает в 2 фазы. В первую фазу основную роль играет МСГ(цитохром Р450), лекарственный препарат вступает в реакции окисления, гидроксилирования, гидролиза а также восстановления. Все те ферменты, которые относятся к семейству цитР450, являются монооксигеназами, которые в качестве кофермента содержат железосодержащий гем. Группа гема переводит кислород в активную форму. Вначале атом железа Fe³+, далее цитохром начинает связывать субстрат, расположенный рядом с гемом. В свою очередь, трехвалентное железо восстанавливается до двухвалентного и присоединяет молекулу кислорода. Электроны с НАДФН Н+ переносятся, атом железа окисляется, восстановленный атом Fe восстанавливает связанный кислород в пероксид. От промежуточного продукта отщепляется ион гидроксила, образуется молекула воды и реакционноспособный кислород. Атом кислорода, став активным, атакует связь С-Н субстрата и образуется гидроксигруппа. Когда продукт реакции освобождается, фермент возвращается в свое исходное состояние. НАДН Н+ участвует в реакции в качестве восстановителя.
RH (субстрат)+ О2+НАДН Н+ -> ROH(продукт)+Н2О+НАДФ+ .
Рис. 1. Этапы гидроксилирования субстрата цитохромом Р450.
Как уже было упомянуто выше, цитохром Р450 участвует в реакциях гидроксилирования алифатического или ароматического атома углерода, перенос окисленной группы, изомеризации, N-гидроксилидегалогенирование, эпоксидирование двойной связи, оксигенирование гетероатомов (S-, N-), разрушение двойной связи и так далее. Допустим, в качестве примера можно привести гидроксилирование анилина и его превращение в n-аминофенол.
Цитохромы Р450 являются семейством изоформ. Определенная изоформа кодируется отдельным геном. К настоящему времени у человека известно 25 цитР450. Они распространены в клетках органов и тканей. Наибольшая концентрация цитР450 обнаруживается в клетках печени-гепатоцитах. .
Некоторые лекарственные препараты способны индуктировать работу цитохромов Р450, тем самым ускоряется детоксикация, и метаболиты быстрее выводятся из организма. Например, к ним относится фенолбарбитурат. Его длительное применение в качестве снотворного усиливает метаболизм и постепенно уменьшается время сна.
Эти лекарственные препараты активируют транскрипцию генов цитохромов, их вырабатывается большее количество, и они лучше утилизируют метаболиты.
Кроме того, на индукцию цитохромов Р450 влияют не только лекарственные препараты, но и стресс, а также определенные физические воздействия.
Индукция цитохрома Р450 может иметь и негативные последствия, так как может служить причиной взаимодействия лекарственных препаратов между собой. Допустим, принятие лекарственного препарата и сока грейпфрута может вызвать побочное действие и снизить эффективность средства.
Также индукция цитохрома одним препаратом может оказывать влияние на метаболизм другого препарата. В качестве примера можно привести снижение уровня препарата в крови из-за воздействия зверобоя дырчатого. Это может значительно ухудшить состояние больного.
Для предотвращения нежелательных последствий необходимо знание индукторов и ингибиторов изоформ цитР450.
К сожалению, существуют генетические нарушения и дефекты генов, отвечающих за выработку различных изоформ цитохрома Р450 и вызывают их полиформизм.
Были проведены исследования антиаритмического лекарственного средства спартеина, в ходе которых было выявлено, что у части испытуемых проявляются побочные действия, такие как фотопсия, двоение в глазах, головная боль и нарушения аккомодации. Оказывается, что спартеин не подвергался метаболизму у некоторых испытуемых из-за дефекта цитР2D6.
Существуют два пути обезвреживания метаболитов в печени.
- Гепатотоксичное лекарство при нарушении процессов детоксикации приводит в развитию гепатотоксочности.
- Безвредное лекарство метаболизируется цитР450 в реактивный либо потенциально токсичный метаболит.
Примером может служить относительно безвредный парацетамол. Слишком большая принятая доза может послужить развитием центролобулярных некрозов и печеночной недостаточности.
Значение цитохрома Р450 невозможно переоценить. Именно благодаря этой системе ферментов печень выполняет свою важную функцию-детоксикационную. Благодаря этому все те лекарственные препараты, которые мы принимаем, успешно метаболизируются и выводится из организма.
Недостаток ферментов семейства цитР450 ведет к тяжелым и часто необратимым последствиям.
Список литературы:
- Райс Р.Х., Гуляева Л.Ф., Биологические эффекты токсических соединений: Курс лекций/Новосибирский гос. университет. Новосибирск, 2003. – 208 с.
- Таганович А.Д. Патологическая биохимия /Таганович А.Д.,Олецкий Э.И., Котович И.Л./Под общей редакцией Тагановича А.Д. – М.: Издательство БИНОМ. 2013 – 448с.:ил.
- Roeder M.W/ Cytochrome P450 enzymes and genotype-guided drug therapy// Cur Mol. Ther. 2009 – Vol.11, N 1:P.1 632-40.
Цитохром Р450. Авторы открытия М.Клингерберг и Д.Гарфинкель установили, что этот фермент по химической природе простетической группы может быть отнесен к цитохромам типа и. Т.Омура и Р.Сато в 1964 г. обнаружили, что комплекс восстановленного гемопротеина с окисью углерода имеет характерный максимум при 450 нм, что и определило название фермента. Однако использование слова "цитохром" применительно к гемопротеинам класса Р450 нельзя считать удачным, так как функцией цитохромов является перенос электронов, а не катализ монооксигеназных реакций. В рекомендациях по номенклатуре семейства Р450, предложенной Д. Небертомб слово "цитохром" упоминается только при расшифровке обозначения CYP (т.е. cy- tochrome З450), которое и используется при обозначении генов Р450.
В настоящее время известно более 150 различных Р450, обнаруженных в животных, растениях, грибах, бактериях. Только у строго анаэробных бактерий гемопротеин отсутствует. Прокариоты содержат растворимый Р450. Переход к эукариотическим системам сопровождается встраиванием Р450 в мембрану, как в случае дрожжей и грибов. Все цитохромы Р450 высших организмов - мембранные ферменты. В эволюционном плане наиболее древней является бактериальная монооксигеназа
На промежуточной стадии эволюционной лестницы стоит митохондриальная гидроксилазная система надпочечников. Она имеет все при- знаки бактериальной растворимой системы и также состоит из трех компонентов. Два ее компонента - FAD-содержащий флавопротеин (NADPH- или NADH-зависимая редуктаза) и негеминовый серосодержащий белок (адренодоксин) - водорастворимы и локализованы в матриксе ми- тохондрий, третий - Р450 встроен в мембрану. Обращает на себя вни- мание высокая субстратная специфичность митохондриальных гемопро- теинов, что делает эту систему еще более похожей на бактериальную. Митохондриальные цитохромы Р450 участвуют главным образом в окисле- нии эндогенных субстратов.
На самой высокой ступени эволюционной лестницы стоит монооксигеназная система микросом печени .
Р450 играют важную роль в окислении многочисленных соединений, как эндогенных (стероиды, желчные кислоты, жирные кислоты, проста- гландины, лейкотриены, биогенные амины), так и экзогенных (лекарства, яды, продукты промышленного загрязнения, пестициды, канцерогены, мутагены и т.п.), последние называют ксенобиотиками .
По типу катализируемых реакций Р450 можно отнести к монооксигеназам внешнего типа. В присутствии доноров электронов (NAD(P)H) Р450 способен активировать молекулярный кислород, один атом которого затем внедряется в молекулу окисляемого субстрата, а другой восстанавливается до воды"
R + AH + O L ROH + A + H O где R - субстрат, ROH - продукт, AH - донор электронов.
Оксигеназные реакции, катализируемые цитохромом Р450, весьма разнообразны. Одна из наиболее широко распространенных реакций окисления ксенобиотиков - реакция окислительного деалкилирования, которая сопровождается окислением алкильной группы, присоединенной к N-, O- или S-атомам. Второе место по распространенности принадлежит реакциям гидроксилирования циклических соединений, которые включают гидроксилирование ароматических, предельных и гетероциклических углеводородов. Р450 может также катализировать реакции гидроксилирования алифатических соединений, N-окисление, окислительное дезаминирование, реакции восстановления азо- и нитросоединений. Реакции окисления природных соединений включают w-окисление насыщенных жирных кислот, гидроксилирование стероидных гормонов, желчных кислот и холестерина, биосинтез простагландинов, перекисное окисление ненасыщенных жирных кислот.
В отличие от других гемопротеинов, обладающих как правило в клетке лишь одной активностью и строго определенной функцией, Р450 наряду с монооксигеназной может проявлять и оксидазную активность, генерируя активные формы кислорода в виде суперокисного и гидрок- сильного радикалов, перекиси водорода. В связи с этим в литературе иногда Р450 называют оксидазой со смешанной функцией. А.И. Арчаков с сотр. обнаружили, что Р450 может функционировать и как истинная четырехэлектронная оксидаза, генерируя только воду из молекулы кисло рода. Р450 обнаруживает и пероксидазную активность, используя в реакции окисления в качестве косубстратов, вместо NAD(P)H, органи- ческие перекиси или перекись водорода. Имеются данные, что Р450 может катализировать диоксигеназные реакции. Таким образом, характер- ной особенностью Р450 является множественность функций, но основной является монооксигеназная. На рис. 1.32 представлена общая схема оксигеназной и оксидазных реакций. На 1-ой стадии оксигеназного цикла (цикл а) происходит связывание субстратов с окисленной формой Р450 с образованием фермент-субстратных комплексов. При этом в зависимости от субстратов могут появляться три типа спектральных из- менений: I, II и модифицированный II, характеризующиеся в дифференциальном спектре поглощения максимумом и минимумом при определенных длинах волн. Субстраты I типа взаимодействуют в основном с низко- спиновой формой Р450 и атом железа из шестикоординированного низко- спинового состояния переходит в пятикоординированное высокоспиновое состояние. В образовании комплексов I типа ведущую роль играют гидрофобные взаимодействия неполярных субстратов с активным центром фермента. Комплексы типа II возникают в результате взаимодействия аминогруппы субстрата с атомом железа гема, находящимся либо в вы- сокоспиновом, либо в низкоспиновом состояниях. При этом высокоспиновая форма железа переходит в низкоспиновую. Железо гема в таких комплексах находится в шестикоординированном состоянии, причем ме- сто связывания кислорода занято азотом субстрата. Модифицированный тип II спектральных изменений является результатом взаимодействия гидроксильной группы субстрата с высокоспиновой формой железа. Ско- рость взаимодействия субстратов I типа с Р450, как правило, на по- рядок выше, чем II типа. На 2-ой стадии монооксигеназного цикла происходит восстановление комплекса Р450-субстрат. Электрон для восстановления цитохрома Р450 поступает от NADPH-специфичного флавопротеина. На следующих стадиях происходит активация кислорода. Для этих стадий характерно последовательное образование окси- и пероксикомплексов Р450. Оксикомплекс Р450 способен диссоциировать с освобождением суперокисных радикалов, из которых в реакции дисмута- ции генерируется перекись водорода (цикл б). Восстановление окси- комплекса вторым электроном ведет к образованию двухэлектронновос- становленного пероксикомплекса. Считается, что эта стадия является лимитирующей в монооксигеназном цикле. При распаде пероксикомплекса генерируется перекись водорода (цикл в) и образуется реакционноспо- собная частица оксеноида (FeO) , содержащая шестиэлектронный атом кислорода, лигандированный трехвалентным железом. Кислородный атом из этой частицы может переноситься к С-Н-связи субстрата и внедряться в нее. В качестве другого механизма предлагается возможность ацилирования дистального атома кислорода, лигандированного на желе- зе гема. Распад этого комплекса ведет к образованию надкислоты в активном центре Р450. Низкая реакционная способность надкислоты требует дополнительной активации молекулы субстрата. Двухэлектрон- ное восстановление оксеноида ведет к образованию воды из молекулы кислорода (цикл г). Вероятнее всего, единого механизма для реакций, катализируемых цитохромом Р450, не существует.
К настоящему времени идентифицированы более 160 разных генов, кодирующих Р450. Сведения о первичной структуре, субстратной специ- фичности, индуцибельности, локализации в клетке, строении гена и многих других свойствах приведены в компьютерной базе данных "Cyto- chrome P450, Database" (CPD), созданной в Институте биомедицинской химии РАМН.
Молек. масса различных Р450 колеблется от 44 до 60 кДа. Мономеры гемопротеина состоят из одной полипептидной цепи, содержащей от 45 до 55% неполярных аминокислотных остатков. В отсутствие детергента цитохром существует в виде агрегатов с молек. массой от 300 до 700 кДа. Полная аминокислотная последовательность установлена для более чем 150 цитохромов Р450. Наиболее хорошо исследованы CYP2B4 и CYP1A2, выделенные из микросом печени кроликов после ин- дукции фенобарбиталом и 3-метилхолантреном соответственно. Молекула CYP2B4 состоит из 491 аминокислотных остатковб а CYP1A2 - из 516 аминокислотных остатков. Д. Озолс и др. в 1981 г. и О. Гото и др. в 1983 г. при сравнении первичной структуры гемопротеинов семейств CYP2 и CYP1 обнаружили 2 консервативных участка